细胞培养进口血清进口胎牛血清进口新生牛血清进口猪血清马血清
细胞培养进口血清进口胎牛血清进口新生牛血清进口猪血清马血清 支原体检测盒及标准品常规PCR检测试剂盒荧光定量PCR检测(qPCR法)支原体DNA提取灵敏度标准品(方法验证用)特异性标准品(方法验证用)PCR定量标准品(可用于方法验证)
支原体检测盒及标准品常规PCR检测试剂盒荧光定量PCR检测(qPCR法)支原体DNA提取灵敏度标准品(方法验证用)特异性标准品(方法验证用)PCR定量标准品(可用于方法验证) 支原体祛除试剂细胞中支原体祛除环境支原体祛除水槽支原体祛除
支原体祛除试剂细胞中支原体祛除环境支原体祛除水槽支原体祛除 干细胞培养基
干细胞培养基 DNA/RNA污染祛除DNA/RNA污染祛除试剂DNA污染监测
DNA/RNA污染祛除DNA/RNA污染祛除试剂DNA污染监测 RNA病毒研究试剂RNA病毒检测试剂盒病毒RNA提取
RNA病毒研究试剂RNA病毒检测试剂盒病毒RNA提取 PCR仪器及配套产品DNA污染监测祛除PCR/qPCR仪性能检查PCR试剂PCR试剂盒PCR预混液(冻干粉)热启动聚合酶MB Taq DNA
PCR仪器及配套产品DNA污染监测祛除PCR/qPCR仪性能检查PCR试剂PCR试剂盒PCR预混液(冻干粉)热启动聚合酶MB Taq DNA 微生物PCR检测食品检测类产品食品微生物检测细菌PCR检测
微生物PCR检测食品检测类产品食品微生物检测细菌PCR检测
- 细胞培养进口血清进口胎牛血清进口新生牛血清进口猪血清马血清
- 支原体检测盒及标准品常规PCR检测试剂盒荧光定量PCR检测(qPCR法)支原体DNA提取灵敏度标准品(方法验证用)特异性标准品(方法验证用)PCR定量标准品(可用于方法验证)
- 支原体祛除试剂细胞中支原体祛除环境支原体祛除水槽支原体祛除
- 干细胞培养基
- DNA/RNA污染祛除DNA/RNA污染祛除试剂DNA污染监测
- RNA病毒研究试剂RNA病毒检测试剂盒病毒RNA提取
- PCR仪器及配套产品DNA污染监测祛除PCR/qPCR仪性能检查PCR试剂PCR试剂盒PCR预混液(冻干粉)热启动聚合酶MB Taq DNA
- 微生物PCR检测食品检测类产品食品微生物检测细菌PCR检测
|
|
【2018年全国药品微生物检验控制技术精要培训班会议】在宁波拉开帷幕!2018-11-29 09:02来源:缔一生物
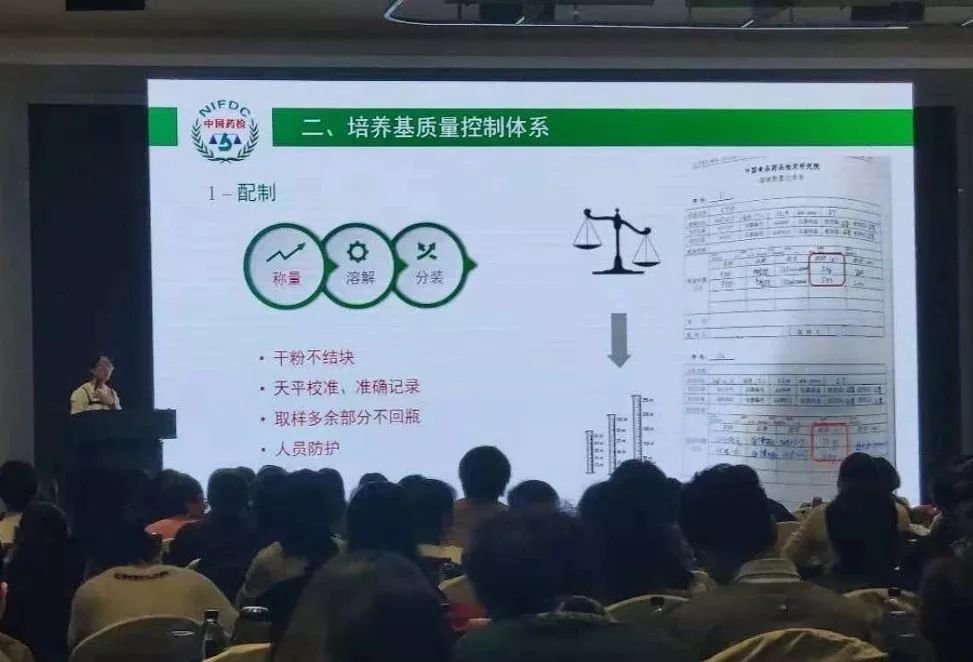
《中国药典》2020年版相关微生物增修订内容陆续公示,国家关于药品微生物控制技术指南相继出台。 为把握标准动态,提升技术水平,应对当前药品微生物检验控制的迫切需求,11月28-30日,2018年全国药品微生物检验技术精要培训班在浙江省宁波市拉开帷幕。
今天上午,中国食品药品检定研究院化药所首席专家吴昌勤讲述了“我国药品微生物检验控制现状与发展”。他首先回顾了历年中国药典的修订和主要变化。 例如: 2015年版中国药典,在检验理念上,已经从简单的终产品检验,向风险调查、风险评估、风险管理方向转变;并且促使药企的微生物实验室,在对样品的前处理、实验过程控制、污染菌的鉴定和溯源分析等方面形成SOP,进而促进药品微生物检验能力的提升。
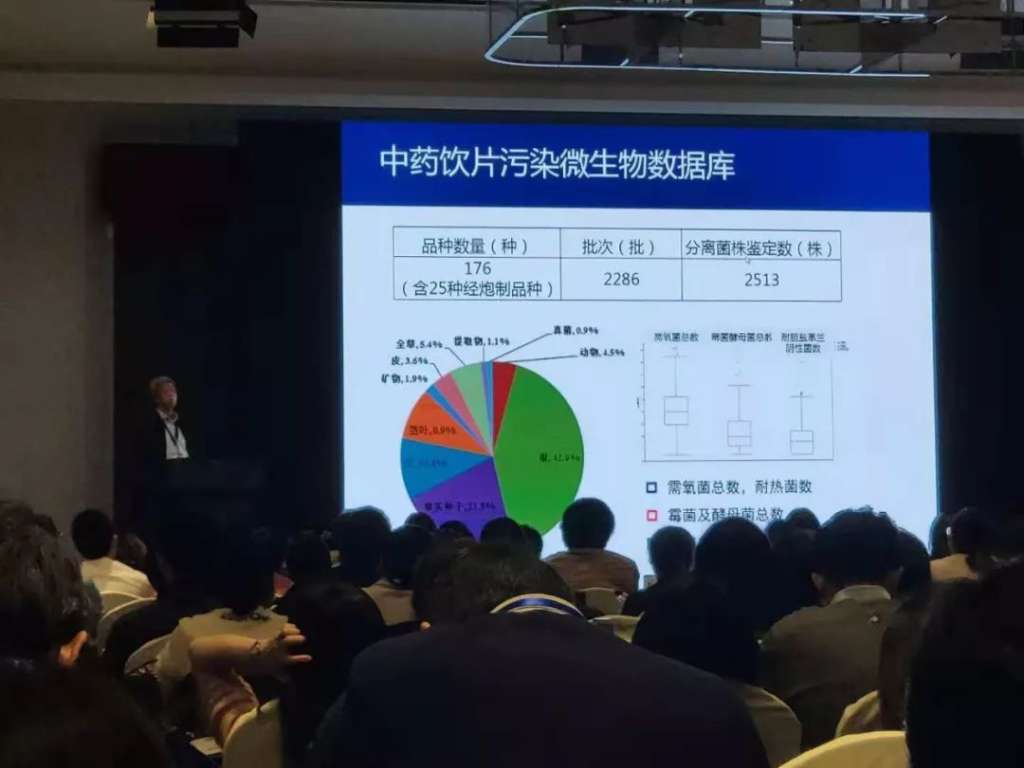
在中国药典2020年版的修订方面,他提到化学药品将以注射剂再评价为契机,深入探讨注射剂生产过程中无菌保障体系的评估与调查策略,促使企业成为控制微生物污染的主体,其目标是使化学药品全面与国际接轨。 中药是我国的特色。药典制定委员会将在已建立的中药饮片污染微生物数据库的基础上,以中药饮片微生物限度标准的制定为突破口,基于风险控制理念,探讨不同用途中药控制微生物污染的策略与方法,使中药标准符合药材生产和应用的特点。
紧接着,中国食品药品检定研究院化药所微生物室副主任马仕洪,报告了当前几起药品微生物事件引起的反思,以及不可接受微生物的概念。 他首先从一例化学药微生物污染事件讲起。有一例介入治疗的患者出现腔道感染和菌血症。经调查,污染源是来自凝胶剂中的洋葱伯克霍尔德菌。这个不应该出现的严重药品微生物事件,不仅警示我们药品的微生物标准仍需完善,也提出对于不可接受微生物,应引起重视和加强检查。
不可接受微生物是指那些已知有明显致病性,存在足够数量,通过产品的给药途径可能导致患者不可接受风险的微生物。《中国药典-四部通则107》“非无菌药品微生物限度标准”规定,对于原料辅料以及某些特定的制剂,应根据其特性和生产工艺,可能还需检查其他具有潜在危害的微生物。 |
 |
 细胞培养进口血清
细胞培养进口血清 支原体祛除试剂
支原体祛除试剂 干细胞培养基
干细胞培养基