產(chǎn)品目錄
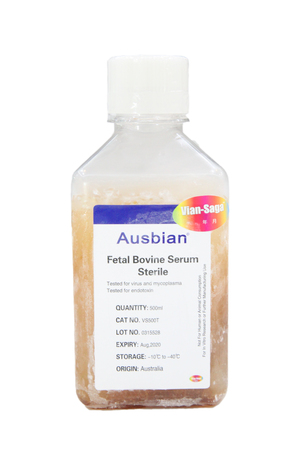
 細(xì)胞培養(yǎng)進(jìn)口血清進(jìn)口胎牛血清進(jìn)口新生牛血清進(jìn)口豬血清馬血清
細(xì)胞培養(yǎng)進(jìn)口血清進(jìn)口胎牛血清進(jìn)口新生牛血清進(jìn)口豬血清馬血清 支原體檢測盒及標(biāo)準(zhǔn)品常規(guī)PCR檢測試劑盒熒光定量PCR檢測(qPCR法)支原體DNA提取靈敏度標(biāo)準(zhǔn)品(方法驗證用)特異性標(biāo)準(zhǔn)品(方法驗證用)PCR定量標(biāo)準(zhǔn)品(可用于方法驗證)
支原體檢測盒及標(biāo)準(zhǔn)品常規(guī)PCR檢測試劑盒熒光定量PCR檢測(qPCR法)支原體DNA提取靈敏度標(biāo)準(zhǔn)品(方法驗證用)特異性標(biāo)準(zhǔn)品(方法驗證用)PCR定量標(biāo)準(zhǔn)品(可用于方法驗證) 支原體祛除試劑細(xì)胞中支原體祛除環(huán)境支原體祛除水槽支原體祛除
支原體祛除試劑細(xì)胞中支原體祛除環(huán)境支原體祛除水槽支原體祛除 干細(xì)胞培養(yǎng)基
干細(xì)胞培養(yǎng)基 DNA/RNA污染祛除DNA/RNA污染祛除試劑DNA污染監(jiān)測
DNA/RNA污染祛除DNA/RNA污染祛除試劑DNA污染監(jiān)測 RNA病毒研究試劑RNA病毒檢測試劑盒病毒RNA提取
RNA病毒研究試劑RNA病毒檢測試劑盒病毒RNA提取 PCR儀器及配套產(chǎn)品DNA污染監(jiān)測祛除PCR/qPCR儀性能檢查PCR試劑PCR試劑盒PCR預(yù)混液(凍干粉)熱啟動聚合酶MB Taq DNA
PCR儀器及配套產(chǎn)品DNA污染監(jiān)測祛除PCR/qPCR儀性能檢查PCR試劑PCR試劑盒PCR預(yù)混液(凍干粉)熱啟動聚合酶MB Taq DNA 微生物PCR檢測食品檢測類產(chǎn)品食品微生物檢測細(xì)菌PCR檢測
微生物PCR檢測食品檢測類產(chǎn)品食品微生物檢測細(xì)菌PCR檢測
歡迎來到 威正翔禹|締一生物官方網(wǎng)站|咨詢熱線:400-166-8600
咨詢熱線
400-166-8600
產(chǎn)品目錄
- 細(xì)胞培養(yǎng)進(jìn)口血清進(jìn)口胎牛血清進(jìn)口新生牛血清進(jìn)口豬血清馬血清
- 支原體檢測盒及標(biāo)準(zhǔn)品常規(guī)PCR檢測試劑盒熒光定量PCR檢測(qPCR法)支原體DNA提取靈敏度標(biāo)準(zhǔn)品(方法驗證用)特異性標(biāo)準(zhǔn)品(方法驗證用)PCR定量標(biāo)準(zhǔn)品(可用于方法驗證)
- 支原體祛除試劑細(xì)胞中支原體祛除環(huán)境支原體祛除水槽支原體祛除
- 干細(xì)胞培養(yǎng)基
- DNA/RNA污染祛除DNA/RNA污染祛除試劑DNA污染監(jiān)測
- RNA病毒研究試劑RNA病毒檢測試劑盒病毒RNA提取
- PCR儀器及配套產(chǎn)品DNA污染監(jiān)測祛除PCR/qPCR儀性能檢查PCR試劑PCR試劑盒PCR預(yù)混液(凍干粉)熱啟動聚合酶MB Taq DNA
- 微生物PCR檢測食品檢測類產(chǎn)品食品微生物檢測細(xì)菌PCR檢測
 細(xì)胞培養(yǎng)進(jìn)口血清
細(xì)胞培養(yǎng)進(jìn)口血清 支原體祛除試劑
支原體祛除試劑 干細(xì)胞培養(yǎng)基
干細(xì)胞培養(yǎng)基